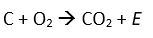Heute gab es einen magischen Moment in meinem Chemiker Leben. Ich führte Schüler*Innen einer Grundschule die Wirkung von Salzsäure vor. Salzsäure, eine klassische Mineralsäure mit der Formel HCl, ist korrosiv gegenüber Metallen. Magnesium und Eisen lösen sich unter Bildung von Wasserstoff und Hitzeentwicklung relativ schnell auf, edlere Metalle wie Gold lösen sich nicht auf.
Ich löste vor den Augen der Schüler*Innen ein Stück Magnesiumband auf, was wiederum eine lebhafte Diskussion unter den Schüler*Innen auslöste, was sich alles sonst noch oder gerade nicht in Salzsäure auflöst. Als ich meinte, Gold löse sich nicht auf, und auf meinen Ring an meiner rechten Handzeigte, wusste ich, was auf mich zu kommen würde: Ein Moment, in dem ich meinem Wissen über Chemie zu 100% vertraute. Und das fühlte sich sehr gut an. Ich zog meinen Ring aus und lies ihn in das Becherglas mit der heißen Salzsäure fallen. Und es passierte – …!

Kleiner Einschub: Gold kam nach heutiger Theorie vor Milliarden Jahren als Ergebnis eines Supernova-Kernkollapses auf die sich bildende Erde und ist schon seit mehr als 6.000 Jahren der Menschheit bekannt. Es wird zum überwiegenden Teil als Geldanlage und als Schmuck verwendet, nur knapp 8 % des Goldes wird in der Industrie eingesetzt, und dort besonders in den Bereichen Elektronik, Optik und Medizin. Gold ist neben ein paar anderen Metallen ein sogenanntes Edelmetall. D.h. es ist besonders beständig gegenüber anderen Chemikalien.

Neben Gold gelten auch Silber, Platin und Palladium als Edelmetalle. Die chemische Stabilität von Gold und den im Periodensystem benachbarten Edelmetallen ist in der besonderen Elektronenkonfiguration begründet. Jedes Atom besteht einer spezifischen Anordnung von Protonen, Neutronen und Elektronen. Die Elektronen des Goldes befinden sich vorzugsweise in recht geringen Abständen zu dem Atomkern und tragen somit nicht zur Reaktionsaktivität des Goldes bei. Auch treten bei Gold und anderen schweren Edelmetallen relativistische Effekte auf, da die Elektronen sich im Gegensatz zu den Elektronen von unedlen Metallen eine Geschwindigkeit haben, die der Lichtgeschwindigkeit nahe kommt.
Vielleicht tragt ihr auch Schmuck aus diesen Edelmetallen, oder Mischungen aus diesen Edelmetallen, die auch Legierungen genannte wird. Der Ring, den ich in die heiße Salzsäure legte, besteht aus 75% Gold und ca. 25% Silber. Und er löste sich nicht auf. Es überraschte mich nicht wirklich, ich war mir ziemlich sicher. Die Schüler*Innen hielten trotzdem den Atem an, einige waren sogar etwas erschrocken, hatte ich ihnen doch zuvor gezeigt, wie sich ein Stück Magnesium und ein alter Nagel in der Säure auflöste.
Warum war dieser Moment magisch für mich? Weil ich der Wissenschaft vertraute und nicht enttäuscht wurde. Weil ich die Stimmung bei den Schüler*Innen mitbekam, die von Aufregung und Begreifen geprägt war. Und weil dieses kleine Experiment mit einem Ring aus Gold durchgeführt habe. Der Begriff Gold wird vielfach euphemistisch eingesetzt. Das schwarze Gold (Öl), das flüssige Gold (Honig), der goldene Oktober. Auch im zwischenmenschlichen spielt Gold eine Rolle, steht es doch für Langlebigkeit und Wertigkeit einer Beziehung. Gold und Goldringe haben auch eine mystische und literarische Bedeutung, ich muss direkt an den Ring der Nibelungen oder den „Einen Ring“ aus Tolkiens Mittelerde denken. Und weil Gold emotional so aufgeladen ist, war es ein besonderer und magischer Moment, als ich dieses Experiment mit meinem Goldring durchführte und mich die Wissenschaft nicht enttäuschte.
Vertraut der Wissenschaft!
Mit goldigen Grüßen,
Hendrik Fischer